Alertas críticas sobre tubos de traqueostomía Smiths Medical Riesgos y acciones ante defectos de fabricación
- Smiths Medical (ahora ICU Medical) ha sido objeto de investigación por varios defectos de fabricación en sus tubos de traqueostomía, lo que ha provocado retiradas de productos a nivel global y alertas de la AEMPS en España.
- Los principales defectos incluyen el riesgo de desgarro en la brida de fijación de los tubos Bivona® (neonatales/pediátricos y de adultos), que puede causar decanulación y ventilación inadecuada.
- Otro problema clave es la desconexión del balón piloto en los kits BLUselect®, BLUgriggs® y BLUperc®, lo que compromete la presión del manguito y aumenta el riesgo de aspiración y ventilación ineficaz.
- Ambos tipos de defectos han sido clasificados como de Clase I por la FDA (la más grave) y se han asociado con lesiones graves y, en el caso de Bivona®, con dos muertes.
- Las acciones requeridas para profesionales y distribuidores incluyen verificar el inventario, interrumpir el uso, poner en cuarentena o desechar los productos afectados y notificar los incidentes.
En mi experiencia, la seguridad de los dispositivos médicos es un pilar fundamental en la atención sanitaria. Las investigaciones sobre los tubos de traqueostomía de Smiths Medical, ahora parte de ICU Medical, han puesto de manifiesto una serie de defectos de fabricación que han generado importantes alertas de seguridad a nivel global y, por supuesto, en España a través de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Estos dispositivos son críticos para la supervivencia y calidad de vida de muchos pacientes, y cualquier fallo en su diseño o manufactura puede tener consecuencias devastadoras. Por ello, la seriedad con la que se abordan estas situaciones es máxima.
La tecnovigilancia, desde mi perspectiva, es el sistema nervioso central en el monitoreo de la seguridad de los productos sanitarios. Es el proceso mediante el cual organismos como la AEMPS identifican, evalúan y gestionan los riesgos asociados a los dispositivos médicos una vez que ya están en el mercado. Su papel es fundamental para asegurar la protección del paciente, permitiendo la implementación de medidas correctivas rápidas y eficaces. Sin una tecnovigilancia robusta, los defectos pasarían desapercibidos, poniendo en peligro la vida de los usuarios.
Las alertas de seguridad, como las que nos ocupan con los productos de Smiths Medical, se originan generalmente a partir de reportes de incidentes adversos por parte de profesionales de la salud o los propios pacientes, o bien mediante la vigilancia activa del fabricante. En España, la AEMPS es la entidad encargada de procesar esta información y emitir las notificaciones oficiales, que son el resultado directo de la identificación de defectos de fabricación que requieren la retirada de productos del mercado para salvaguardar la salud pública.Análisis detallado de los productos Smiths Medical bajo investigación
Uno de los casos más preocupantes que hemos observado se centra en los tubos de traqueostomía Bivona®, tanto en sus versiones neonatales/pediátricas como en las de adultos. El defecto específico identificado es el riesgo de desgarro en la brida de fijación, ese reborde esencial que sujeta el tubo al cuello del paciente. Este fallo estructural puede comprometer gravemente la vía aérea, provocando el desplazamiento o, lo que es aún más crítico, la decanulación accidental del tubo. La gravedad de este problema ha llevado a la FDA a clasificar esta retirada como de Clase I, la categoría más seria, y se han reportado al menos 35 lesiones graves y, lamentablemente, dos muertes asociadas a este defecto.
Las consecuencias clínicas del desgarro de la brida de sujeción son, sin exagerar, potencialmente mortales. Una decanulación o un desplazamiento inesperado del tubo puede impedir de forma inmediata una ventilación adecuada, lo que en pacientes dependientes de la vía aérea artificial puede desencadenar un "evento adverso catastrófico". Esto significa que el paciente puede sufrir hipoxia severa, daño cerebral irreversible o incluso la muerte en cuestión de minutos si no se interviene de inmediato y de manera efectiva.
La clasificación de riesgo Clase I otorgada por la FDA es un indicativo inequívoco de la máxima seriedad. Significa que existe una alta probabilidad de que el uso de estos dispositivos cause consecuencias adversas graves para la salud o la muerte. Es crucial que los profesionales de la salud comprendan esta clasificación. Las alertas oficiales emitidas por la AEMPS, que siempre recomiendo consultar, especifican con precisión los lotes afectados, garantizando que la información sea lo más granular posible para evitar confusiones.
Otro frente de investigación importante ha sido el que afecta a los kits de tubos de traqueostomía BLUselect®, BLUgriggs® y BLUperc®. Aquí, el defecto detectado es la posible desconexión del balón piloto de la línea de inflado. Si esta desconexión ocurre, el manguito del tubo no puede mantener la presión necesaria, lo que conduce a una ventilación inadecuada del paciente. Al igual que en el caso anterior, la FDA ha clasificado esta situación como de Clase I, y se han reportado 12 lesiones relacionadas con este fallo.
Los peligros clínicos inmediatos derivados de la desconexión del balón piloto son significativos. La pérdida de presión en el manguito no solo compromete la ventilación adecuada al permitir fugas de aire, sino que también aumenta drásticamente el riesgo de aspiración de secreciones orofaríngeas o contenido gástrico hacia los pulmones, lo que puede derivar en neumonías graves o síndrome de distrés respiratorio agudo. La seguridad respiratoria del paciente se ve directamente amenazada, requiriendo una intervención urgente.
Es vital recalcar que la identificación de los kits y productos específicos retirados del mercado se realiza mediante números de lote y códigos de producto que se detallan exhaustivamente en las notificaciones oficiales de Smiths Medical y la AEMPS. Mi consejo es que los profesionales sanitarios y los gestores de inventario consulten siempre estos documentos para una identificación precisa y para asegurarse de que ningún producto afectado permanezca en uso.
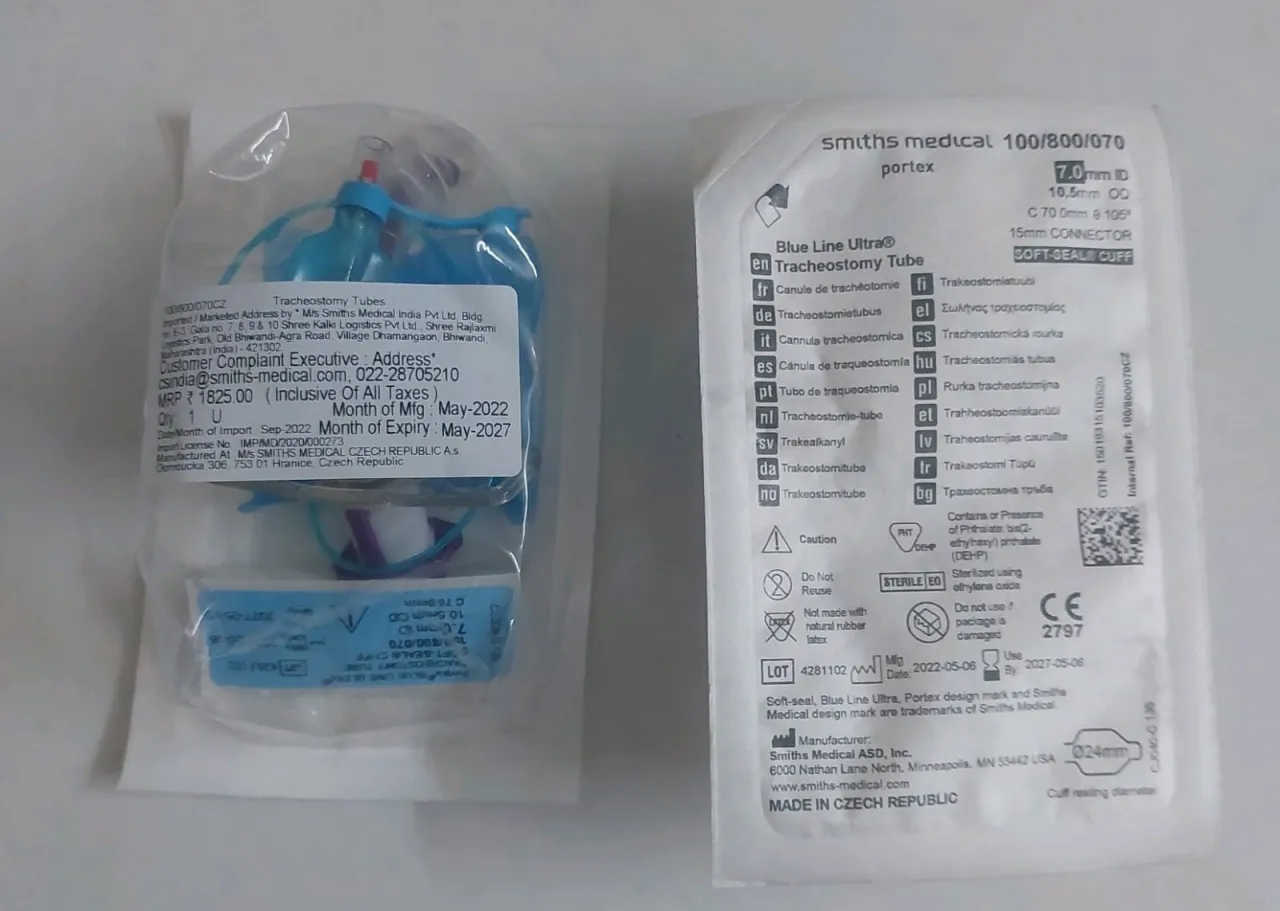
Además de los casos anteriores, se han identificado problemas estructurales en las cánulas de traqueostomía Portex® Blue Line, específicamente relacionados con la placa o brida del cuello. Esto ha llevado a acciones de campo (códigos FA2404-01 y FA2403-01 en algunas jurisdicciones) que implican la retirada y destrucción de los lotes afectados, subrayando la importancia de una vigilancia constante en todos los componentes de estos dispositivos.
Impacto y respuesta del sistema sanitario español ante las alertas
En España, la AEMPS desempeña un papel absolutamente crucial. Esta agencia no solo gestiona las alertas de productos sanitarios, sino que actúa como la fuente oficial y centralizada de información, coordinando las medidas correctivas necesarias. Su labor es asegurar que los centros sanitarios implementen las acciones adecuadas, desde la identificación y retirada de productos hasta la notificación de incidentes, garantizando así la máxima seguridad del paciente en todo el territorio.
Ante una alerta de seguridad de dispositivos médicos, los hospitales y profesionales sanitarios deben seguir unos pasos inmediatos y bien definidos, basados en las "Notificaciones Urgentes de Dispositivos Médicos" emitidas por Smiths Medical. Estos son los puntos clave que, desde mi experiencia, considero imprescindibles:
- La primera acción es la verificación exhaustiva del inventario. Es fundamental identificar con precisión los productos y lotes específicos que han sido afectados por la alerta. Esto requiere un registro detallado y un sistema de trazabilidad eficaz en cada centro.
- Una vez identificados los productos afectados, el proceso es claro: se debe interrumpir inmediatamente su uso. Posteriormente, estos productos deben ser puestos en cuarentena o desechados según las instrucciones proporcionadas por el fabricante y las autoridades sanitarias. Es igualmente importante contactar con los representantes locales para gestionar reemplazos o el crédito correspondiente.
- Finalmente, es crucial la importancia de utilizar los canales de notificación adecuados para reportar cualquier incidente o para realizar consultas. Smiths Medical España, S. L. y la AEMPS son los principales puntos de contacto, y mantener una comunicación fluida con ellos es vital para la seguridad colectiva.
Mirando hacia el futuro: lecciones aprendidas y medidas preventivas
Estas investigaciones tienen profundas implicaciones para los procedimientos de control de calidad en la fabricación de dispositivos médicos. Lo que hemos aprendido es que la necesidad de una supervisión más estricta, la mejora continua de los procesos de diseño y fabricación, y la importancia de la vigilancia post-comercialización son aspectos que no pueden subestimarse. Considero que estos incidentes nos obligan a reflexionar sobre cómo podemos prevenir futuros fallos y asegurar que cada dispositivo que llega al paciente cumpla con los más altos estándares de seguridad.Para los profesionales de la salud, al seleccionar dispositivos de traqueostomía, mis recomendaciones prácticas son las siguientes:
- Diligencia debida: Siempre investiguen a fondo el historial de seguridad de los fabricantes y sus productos.
- Consulta de alertas: Manténganse actualizados con las alertas de seguridad emitidas por la AEMPS y otras autoridades reguladoras.
- Priorización de seguridad: Elijan productos con historiales de seguridad robustos y evidencia de calidad en su fabricación.
- Formación continua: Asegúrense de que el personal esté bien capacitado en el uso, mantenimiento y detección de posibles fallos en los dispositivos.
La responsabilidad del fabricante, Smiths Medical (ahora ICU Medical), es innegable. Han tomado medidas como la emisión de notificaciones urgentes y la facilitación de retiradas. Sin embargo, el verdadero desafío radica en la implementación de acciones correctivas significativas y duraderas en sus procesos de fabricación. Es imperativo que demuestren un compromiso inquebrantable para restaurar la confianza de la comunidad médica y garantizar que la seguridad del producto sea su máxima prioridad en el futuro.
